- 小分子柑橘果胶作为一种有效铅螯合剂对于铅中毒患儿的作用
- 发布时间: 2019-04-12 点击次数:4422
-
小分子柑橘果胶作为一种有效铅螯合剂对于铅中毒患儿的作用
《替代疗法》,2008年7月/8月刊,14-4
赵正言, MD; 梁立, MD; 范晓清, MD; 余钟华, PhD; Arland T. Hotchkiss, PhD; Barry J. Wilk, MA; Isaac Eliaz, MD, MS, LAc
背景• 铅毒性是一个引起全球持续关注的健康问题,而孩子是最容易受到铅暴露的长期影响,他们正迫切地需要一个安全、有效的重金属螯合剂去帮助他们解决每天面临的重金属和铅暴露带来的挑战。
目的• 进行该临床研究,以确定口服小分子柑橘果胶(MCP)是否能有效地降低5到12岁儿童血液中的铅毒性。
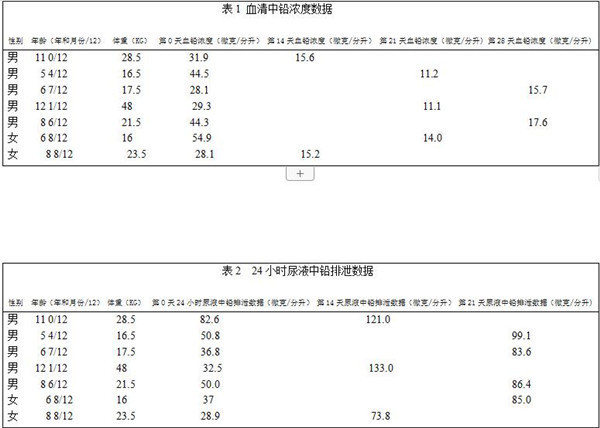
方法• 以石墨炉原子吸收光谱法(石墨炉),对血清水平大于20ug/dL,且试验前三个月没有接受过任何形式的螯合或药物治疗的住院儿童,每日分三次服用共15gMCP。通过石墨炉原子吸收光谱法分析,分别在第0天、14天、21天、28天采集血清和24小时内尿液。
结果• 研究显示血清中铅含量急剧下降((P=.0016; 161% 平均变化) ,24小时尿液中铅含量急剧上升(P=.0007; 132%平均变化)。
结论• 温和安全的重金属螯合物是非常需要的,特别是对高环境长期暴露下的孩子。这次初步试验的显著结果和未观察到的不良反应及之前的关于MCP对成人安全有效的报道表明MCP可以作为重金属螯合物。进一步研究来确定MCP的好处是合理的。(Altern Ther Health Med. 2008;14(4):34-38.)
赵正言、梁立,医学博士,中国杭州浙江大学医学院儿童医院药学院的教授。范晓清,医学博士,加利福尼亚旧金山圣特莱国际公司总裁&首席医疗官。余钟华,博士,圣特莱副总裁&研究员。Arland T.Hotchkiss,博士,宾夕法尼亚温德摩尔美国农业部农业研究局东部地区研究中心首席科学家。Barry J. Wilk,文科硕士,加利福尼亚州圣荷西EcoNugenics公司研究开发部主任。 Isaac Eliaz,医学博士&文科硕士,加利福尼亚塞瓦斯托波尔医疗康复中心医学主任。
摘要
铅是一种无处不在的金属。它出现在我们的环境中,有一些区域比世界上其他国家具有更高的铅水平。铅中毒是影响当今孩子生存的非常重要的慢性环境疾病。尽管也做了许多努力去控制它,铅中毒的情况下仍然会出现在世界各地,特别是在发展中国家。
在幼小机体内,几乎没有系统能对铅毒性带来的影响免疫。铅扰乱多种酶系统。在身体发育中最令人关注的部分是脑。在这个关键时期所遭受的破坏很可能有长远的影响。早期对大脑的铅毒性影响会延续到青少年以及之后的生活中。
非常低水平的铅毒性就会显著损伤大脑,传统的螯合医疗并不能改变这种影响。铅中毒会在许多方面影响大脑,从而导致延迟或逆转的发展,永久学习障碍,抽搐,昏迷,甚至死亡等结果。在美国,铅中毒是儿童最常见的环境疾病。铅中毒的发生在一定程度上受经济状况,特定社区的人口规模,种族,和所居住地长短的影响。但铅中毒可发生在任何一个社会,仅频率不同而已。
据报道,铅中毒已经出现在地球上几乎每一个国家。1996年的一份报告发现居住在中国工业和交通繁忙区的孩子平均血铅水平为21.8(BPB)至67.9微克/分升。血铅值的百分比都在10微克/分升以上,这是在儿童铅中毒的阈值,介于64.9%至99.5%。甚至约50%“未铅暴露”的孩子血铅值也超过10微克/ 分升。低水平的铅暴露,智商的底下,神经的发育以及身体的成长间的相关性无一例外有着高度一致性。
成年人铅中毒通常是因为职业性的暴露。最近在中国医学文献上的一篇文章发表了在1990年和2005年间中国工作场所铅暴露水平及铅中毒的总结报告。报道中作者发现53.7%的平均值都高于全国最大的职业暴露水平。
现有的螯合剂通常会有明显的副作用,会同样螯合人体所需矿物质,并且往往是静脉给药所以需要医疗监护,且通常用于儿童不安全。小分子柑橘果胶(MCP)是标准柑橘果胶纯化的成分,官方确认为安全的产品(GRAS)。 小分子柑橘果胶被认为跟柑橘果胶具有相同程度的安全水平,是已被认可的食品添加剂。
MCP是一种从柑橘类水果果皮中提取的膳食补充剂。柑橘果胶是一种复杂的多糖水溶性纤维。 D-半乳糖醛酸是果胶的主要单糖,但中性糖也存在。D-半乳糖醛酸残基通过α-1,4糖苷键连接在一起。未改性果胶是一种不易消化的多糖,是一种有交叉链的聚合物。本实验中使用的小分子果胶是通过生物酶和改变PH值,把柑橘果胶分解为短链和少分支的分子结构。较低分子量使MCP可以被吸收到血液中,降低的酯化度使MCP更易结合阳离子。 MCP抑制癌细胞转移和降低肿瘤的生长和发展的效果已为人熟知,同时也有降低胆固醇和刺激免疫系统的作用。值得注意的是,MCP只结合和促排有毒重金属,同时不干扰健康人体所必需的矿物质。MCP被证明具有螯合重金属的最佳结构。它含约10%的鼠李糖II,这能结合重金属和不需要的矿物质阳离子。它也显示出能在长时间使用后减少身体中汞元素的负担。
最近的临床数据表明,MCP作为一种重金属螯合剂可发挥重要的治疗作用。癌症患者体内重金属的负荷也引起了广泛的关注,把MCP用于减轻重金属负荷并抑制肿瘤扩散的双重作用是一个重要的临床应用。重金属、普遍存在的环境毒物和异源雌激素,通过DNA损伤,激素调制,免疫抑制,氧化应激和超炎症构成了对身体巨大的损害。它们是在很多癌症中受到特别关注的,包括前列腺癌和乳腺癌。MCP案例研究和试点临床试验都提出,长期使用温和的螯合剂,如MCP,可以有效地降低身体中的重金属负担。 MCP在现有基础上去除重金属和环境毒素的能力在临床上有很大的益处。
在一个试点临床试验中,患者服用MCP后发现尿液中增加了重金属含量,如铅,汞,镉,砷。参与者连续5天服用每天15克MCP,第6天服用20克。比较第一天和第六天24小时尿样基线读数发现,MCP温和的天性是可以安全螯合,无副作用的。在早期的研究中,Gralak等人研究了柑橘果胶对小鼠体内钙,镁,铁,锌,锰,铜吸收的影响。其他可溶性和不溶性纤维增加了粪便中重金属的排泄,但降低了钙,镁,铁,锰,锌,和铜的吸收,但是柑桔果胶就不会影响这些有益元素。因此,MCP是一种选择性螯合剂,能够增加尿液中重金属的排泄,但不减少其它人体必需矿物质。
在另一个试点临床试验中,观察了长期服用MCP对五个研究对象体内汞含量的影响。将250毫克2,3-二巯基-1-丙磺酸(DMPS)静脉注射后,收集6小时内的尿液,以衡量参与者基线身体汞负担。然后MCP施用15克/天的剂量。约4至10个月后再次测量身体汞负担,发现所有受试者汞含量平均降低52微克/克肌酸酐至16微克/克肌酸酐。研究参与者体内汞水平下降了69%(P = 0.03)。
MCP在2例成人临床试验中产生了令人鼓舞的结果,它增加排泄中的重金属含量,减少体内有毒金属。这项临床试验评估了MCP对减少儿童铅毒性的有效性。考虑到在中国城市/工业化地区铅毒性引起的公共健康危机,研究对象是独特的。这篇文章中我们总结了将MCP作为唯一螯合剂和疗法,铅含量在5至12岁患儿血液内的减少和尿液中的增加。
材料和方法
研究在中国杭州的浙江大学儿童医院进行。这项研究招募了七名病人。所有患者均符合血铅浓度>20微克/分升的资格标准,且参与研究前的3个月内没有进行过螯合和/或解毒治疗。每个孩子的父母或监护人参加这个开放标记的临床试验前均需要签署知情同意书。
患者接受每天服用15克MCP,每次5克一日三次。在研究开始前3个月以及研究过程中没有使用其他的螯合或解毒剂。
从开始使用MCP前的第0天,之后每周测量直到患者出院,以石墨炉原子吸收光谱法(GFAAS)对患者的血铅浓度和24小时尿铅排泄进行测定。2周后两位病人出院,3周后3个,4周后两个,他们的血铅水平下降到了低于20微克/分升的标准。
过程中评估了患者在治疗中产生的症状,包括恶化或改善已有的症状,任何新的症状,MCP潜在的副作用,如头痛,腹泻,回流或胃肠道紊乱,心悸,体液潴留等。采用了一般血液分析对不良反应进行了监控,未出现异常结果。 根据病情,本研究的儿童没有任何特殊的饮食。
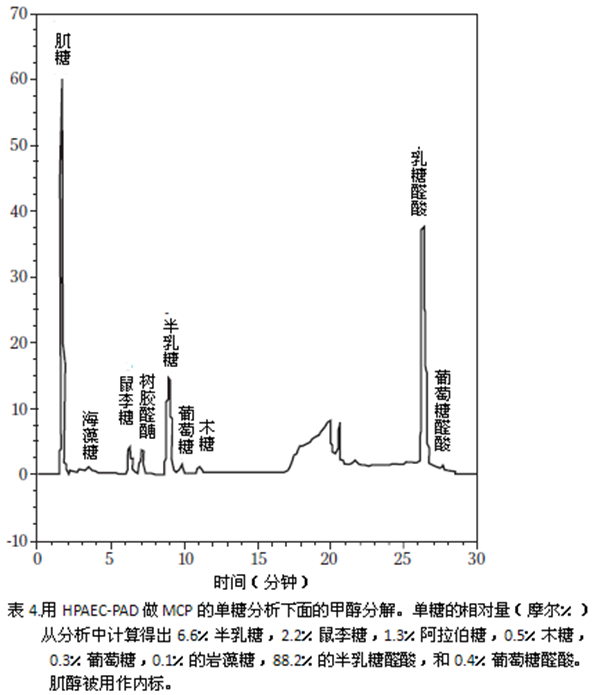
用高效阴离子交换色谱法和脉冲安培检测法(HPAEC-PAD)甲醇分解后进行MCP的单糖分析。使用A戴安DX-500系统(戴安公司,桑尼维尔,加州),包括一个0.5毫升/分钟操作的CarboPac PA-20柱。用14mM的氢氧化钠(NaOH)流动相等浓度处理13分钟,然后将100mM氢氧化钠和0-120 mM乙酸钠(CH3COONa)梯度处理30分钟,将中性和酸性单糖分离。在下一次注射前40分钟将流动相移回14毫米氢氧化钠。其他情况之前已经报道。
结论
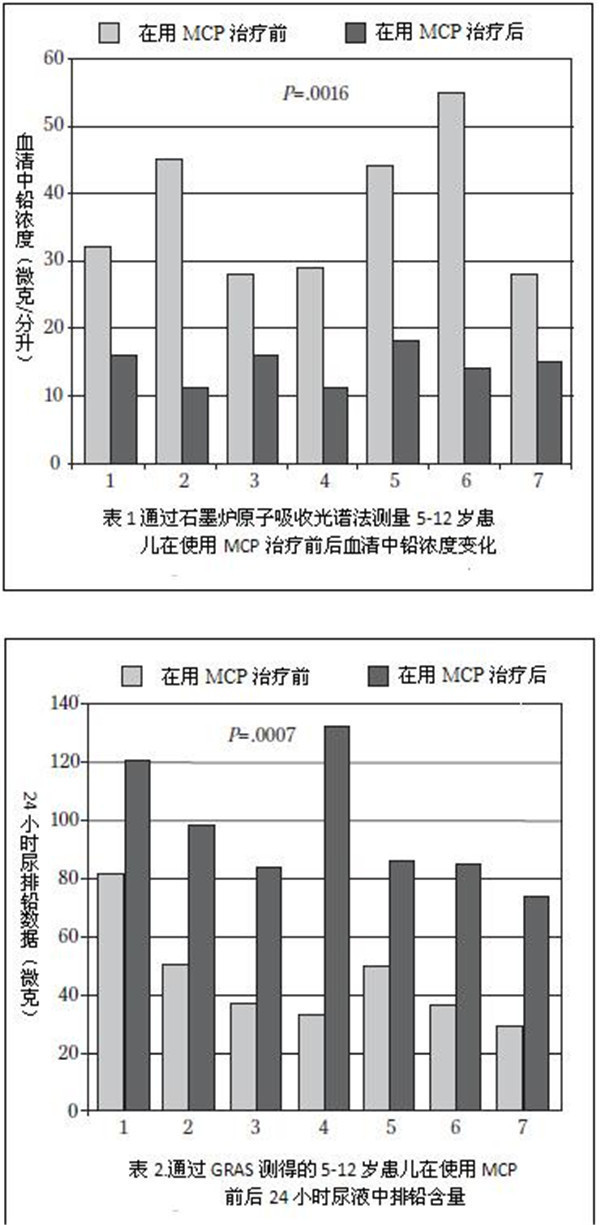
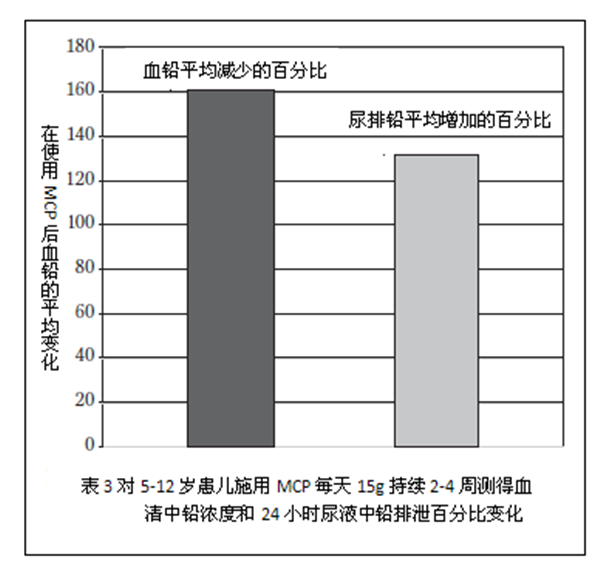
表1总结了使用MCP前后,血铅浓度的变化。所有7个受试者血液中铅含量显著下降。图1显示出了从第0天开始及在治疗过程中测得的峰值血铅浓度的变化。采用配对样本平均值的统计分析结果十分显著(P = .0016)。表2总结了治疗前和峰值时患者24小时总尿排泄铅含量的变化。图2总结了第0天和治疗过程中峰值时患者24小时总尿排泄中铅含量的变化。采用配对样本平均值的统计分析结果非常显着(P=0.0007)。据报告,没有产生不良反应。另有3个儿童年龄在五岁以下(2.5到3.5岁间)也使用了MCP进行治疗,但因为不符合年龄标准未将结果收录在本次实验内。他们也取得了类似的实验结果,且无任何不良反应。图3显示了受试者组24小时血液和尿液中铅含量的平均百分比变化。
图4显示了单糖分析色谱,这表明MCP含88.2%的半乳糖醛酸。就如之前提到的,MCP单糖有着降低的分子量,脱支,更低的酯化度(3.8%),低鼠李II(10%)。
讨论
一般人特别是儿童的铅中毒是一个引起广泛关注的全球健康议题,它会对身体多个系统造成不同程度的健康问题。本临床研究的目的是评估MCP对于铅毒患儿减少铅毒性的有效性。所有测试的受试者尿液中铅含量都显著增加,同时血液中铅含量显著降低。据报告,没有产生副作用。该结果清楚地证明了MCP作为铅螯合剂的有效性和安全性。
不幸的是,这些孩子在关键的发展时期只能又回到长期铅暴露的环境里,导致进一步的铅毒,造成了他们终身的伤害。铅暴露可导致全球数百万儿童的持续健康风险。在解决这个问题的时候,我们需要寻找一种安全的铅移除剂,在移除体内现有铅毒素的同时防止由于持续接触导致的铅吸收。目前,主要用于祛除铅毒性的试剂为乙二胺四乙酸(EDTA),它需静脉注射,成本高,且有潜在的副作用。EDTA,以及其他试剂,如内消旋-2,3-二巯基琥珀酸(DMSA)和DMPS,会消耗人体内必需矿物质并可能会导致重金属的重新分配,使它们在重要器官集中,比如大脑。因此这些药物不适合于继续使用。寻找一种安全和能够长期使用的选择性螯合剂十分必要。长期服用MCP不会造成任何副作用已被多例证实,如用于患前列腺癌的成人(12个月),用于减少成年人体内汞负担(10个月),以及一项使用MCP的病例报告(12个月)。
作为一个系统性的螯合剂,MCP具有降低人体体内重金属负担并不产生副作用的能力。MCP的低酯化度同型半乳糖醛酸和鼠李II 结构中含有丰富的自由羧基,是理想的铅等阳离子的螯合剂。我们认为,在MCP中的鼠李II在螯合重金属和人体非必需矿物阳离子时具有选择性。显然,低分子量和鼠李结构允许MCP通过胃肠摄取后直接将血液中重金属螯合,之后随尿液排出。我们已经将MCP作为重金属螯合剂用于健康人群的临床试验中,慢性疾病的成人身上,重金属超标人群身上,以及此次医院监测的长期铅暴露导致铅中毒的孩子身上。 若将MCP与改性藻酸盐结合,可以增强螯合作用或以更低剂量实现。这里给出的结果显示MCP可以作为一种有效的螯合剂,但仍需更多的临床研究以确认我们的发现以及进一步优化MCP本身或结合改性藻酸盐的广泛应用,尤其是针对解决长期暴露在环境毒素下孩子的问题。
致谢
作者感谢Madhav Yadav 和Andre White给予的技术支持。
参考文献
1. Moore MR, McIntosh MJ, Bushnell IW. The neurotoxicology of lead. Neurotoxicology. 1986;7(2):541-556.
2. Lanphear BP, Hornung R, Khoury J, et al. Low-level environmental lead exposure and children’s intellectual function: an international pooled analysis. Environ Health Perspect. 2005;113(7):894-899.
3. Järup L. Hazards of heavy metal contamination. Br Med Bull. 2003;68:167-182.
4. Rosen JF. Adverse health effects of lead at low exposure levels: trends in the management of childhood lead poisoning. Toxicology. 1995;97(1-3):11-17.
5. Mendelsohn AL, Dreyer BP, Fierman AH, et al. Low-level lead exposure and cognitive development in early childhood. J Dev Behav Pediatr. 1999;20(6):425-431.
6. Shen X, Rosen JF, Guo D, Wu S. Childhood lead poisoning in China. Sci Total Environ. 1996;181(2):101-109.
7. Shen X, Wu S, Yan C. Impacts of low-level lead exposure on development of children: recent studies in China. Clin Chim Acta. 2001;313(1-2):217-220.
8. Ye X, Wong O. Lead exposure, lead poisoning, and lead regulatory standards in China, 1990-2005. Regul Toxicol Pharmacol. 2006;46(2):157-162.
9. Modified citrus pectin monograph. Altern Med Rev. 2000;5(6):573-575.
10. Pienta KJ, Naik H, Akhtar A, et al. Inhibition of spontaneous metastasis in a rat prostate cancer model by oral administration of modified citrus pectin. J Natl Cancer Inst. 1995;87(5):348-353.
11. Hayashi A, Gillen AC, Lott JR. Effects of daily oral administration of quercetin chalcone and modified citrus pectin on implanted colon-25 tumor growth in Balb-c mice. Altern Med Rev. 2000;5(6):546-552.
12. Guess BW, Scholz MC, Strum SB, Lam RY, Johnson HJ, Jennrich RI. Modified citrus pec-tin (MCP) increases the prostate-specific antigen doubling time in men with prostate can-cer: a phase II pilot study. Prostate Cancer Prostatic Dis. 2003;6(4):301-304.
13. Hexeberg S, Hexeberg E, Willumsen N, Berge RK. A study on lipid metabolism in heart and liver of cholesterol- and pectin-fed rats. Br J Nutr. 1994;71(2):181-192.
14. Zhu HG, Zollner TM, Klein-Franke A, Anderer FA. Enhancement of MHC-unrestricted cytotoxic activity of human CD56+ CD3- natural killer (NK) cells and CD3+ T cells by rhamnogalacturonan: target cell specificity and activity against NK-insensitive targets. J Cancer Res Clin Oncol. 1994;120(7):383-388.
15. Eliaz I, Hotchkiss AT, Fishman ML, Rode D. The effect of modified citrus pectin on uri-nary excretion of toxic elements. Phytother Res. 2006;20(10):859-864.
16. Eliaz I, Gaurdino J, Hughes K. The health benefits of modified citrus pectin. In: Patil BS, Turner ND, Miller EG, Brodbelt JS, eds. Potential Health Benefits of Citrus. ACS Symposium Series 936. Oxford, UK: Oxford University Press; 2006:199-210.
17. Eliaz I, Weil E, Wilk B. Integrative medicine and the role of modified citrus pectin/alg-inates in heavy metal chelation and detoxification—five case reports. Forsch Komplement Med (2006). 2007;14(6):358-364.
17. Gralak MA. Leontowicz M, Morawiec M, Bartnikowska E, Kulasek GW. Comparison of the influence of dietary fibre sources with different proportions of soluble and insoluble fibre on Ca, Mg, Fe, Zn, Mn and Cu apparent absorption in rats. Arch Tiernahr. 1996;49(4):293-299.
18. Manderson K, Pinart M, Tuohy KM, et al. In vitro determination of prebiotic properties of oligosaccharides derived from orange juice manufacturing by-product stream. Appl Environ Microbial. 2005;71(12):8383-8389.
19. Kohn R. Binding of toxic cations to pectin, its oligomeric fragments and plant tissues. Carbohydr Polym. 1982;2(4):273-275.
20. O’Neill MA, Warrenfeltz D, Kates K, et al. Rhamnogalacturonan-II, a pectic polysaccha-ride in the walls of growing plant cell, forms a dimer that is covalently cross-linked by borate ester. In vitro conditions for the formation and hydrolysis of the dimer. J Biol Chem. 1996;27(37)1;22923-22930.
- 上一篇:暂无
下一篇: - 返回新闻列表

