- 改性果胶的抗肿瘤机制研究进展
- 发布时间: 2019-05-07 点击次数:5866
改性果胶的抗肿瘤机制研究进展
张文博 1,刘振华 1,袁雪艳 2,高启禹 1,*
(1.新乡医学院生命科学技术学院˗2.新乡医学院公共卫生学院,河南 新乡 453003)
摘要:果胶是一种以聚半乳糖醛酸为骨架、富含中性糖分支结构的植物杂多糖。通过理化手段对果胶进行改性,降低其分子量和酯化度、修佄其微观结构、提高其生物利用度,能抑制肿瘤生长、诱导凋亡、增强肿瘤细胞对化疗药物的敏感性、抑制肿瘤血管新生和转移并增强免疫响应。本文重点综述了改性果胶的抗肿瘤机制、吸收机制和抗肿瘤构效关系,并展望了将其开发为食品的前景。
关键词˖半乳糖凝集素-3;改性果胶;改性ᶥ柑橘果胶;果胶;抗肿瘤
果胶是一种存在于植物㒚胞壁的复杂多糖,可用作食品添加剂和药物辅料[1]通过化学试剂[2-3]ǃ热[4-5]ǃ射线[6]或酶处理[7]等能降低果胶分子量和酯化度,并修佄其微观结构,获得具抗肿瘤活性的改性果胶(modified pectin, MPs)由于 pH 改性柑橘果胶(pH-modified citrus pectin, MCP)在抑制肿瘤生长ǃ抑制肿瘤血管新生ǃ抗肿瘤转移(metastasis)等方面均有活性。本文以 MCP 为代表,总结 MPs 的结构、抗肿瘤活性机制和构效关系(structure-activity relationship, SAR)。
1 果胶结构天然果胶一般含有同聚半乳糖醛酸(homogalacturonan, HG) . 鼠李糖半乳糖醛酸聚糖 I (rhamnogalacturonan-I, RG-I)和取代半乳糖醛酸聚糖(substituted galacturonans, GS)[8-10]。果胶结构随来源.提取工艺等因素化较大,通常 HG 约占 65%,RG-I 占 20~35%,其它为GS柑橘果胶(citrus pectin, CP)中的 RG-I 含量远高于 RG-II [11]。HG 是由D-半乳糖醛酸(D-galacturonic acid, GalpA)经α-1, 4 糖苷键连接的直链分子。商业来源的 CP 其HG 部分的长度大约为20 kD [12]。按照 GalpA 的 C-6 位羧基甲酯化程度(degree of methylation, DM),果胶亦可分为高酯果胶和低酯果胶,它们的性质差别很大。RG-I含有由鼠李糖和半乳糖醛酸组成的核心重复片段„[(→4)-α-D-GalpA-(1→2)-α-L-Rhap-(1→)]noRG-I 的GalpA 一般不连接其它支链。约 20~80%鼠李糖的 C-4 羟基连接有多种结构各异的支链,据植物来源的差异主要存在三种类型的片段„由β-(1,4)键连接的寡聚半乳糖,I 型阿拉伯半乳聚糖(type I arabinogalactan, AG-I)和 II 型阿拉伯半乳聚糖(type II arabinogalactan, AG-II)等三种类型。CP 的RG-I主要由寡聚半乳糖 AG-I 组成,AG-I 由β-(1,4)键和β-(1,3)键连接的两种半乳寡聚糖组成。L-阿拉伯糖常常以ɑ-(1,5)键连接到β-(1,4)键组成的半乳寡聚糖的中间或末端[13-14]。RG-II 是主要的GS,但其结构特征与RG-I 差异较大,其主链为HG 结构,含有 A 和 B 两个侧链。MPs 的结构特征与果胶一致,主要含有HG 主链和 RG-I 支链,但分子量和酯化度更低.分支更少[10]。
1 改性果胶的抗肿瘤活性及机制
MCP 在抑制肿瘤生长.血管新生和转移等多环节起作用,能抑制前列腺癌的肺转移[4].黑色素瘤的肺转移[3].结肠癌的肝转移[15].乳腺癌[16]和血管肉瘤等[17],其抗肿瘤机制涉及对肿瘤生长的抑制. 对化疗药物的增敏.对转移的抑制和对免疫细胞的调控等(图一)。
2.1 改性果胶对肿瘤生长的抑制作用
MCP 等改性果胶能抑制多种类型实体瘤[3,16,18-19]。抑制作用可能涉及发癌过程[20-21].肿瘤细胞增殖.凋亡途径等。MCP 有可能通过抑制其体内靶点半乳糖凝集素-3(galectin-3, Gal-3)与黏蛋白MUC2 相关的作用而抑制结肠癌的发生和转移:有可能作用于LPS/TLR4/NF-κB 途径诱发结肠炎而转化结肠癌[20]:还可能通过影响肿瘤细胞周期而抑制增殖[22-23]。MCP 对肿瘤生长的抑制可能与Gal-3 调制的肿瘤生存信号途径(例如MAPK 途径.Wnt 途径)[24-26]和凋亡途径有关[27]。不过,不同类型MPs 对肿瘤细胞的抑制作用并不一致,可能与改性方法.结构特征有关[4]。肿瘤细胞的异质性也是造成抗肿瘤活性不一致的原因之一。
2.2 改性果胶对化疗药物的增敏作用
化疗增敏剂能够使某些对化疗药物存在抗性的肿瘤细胞能够发生凋亡[28-31]。Chauhan 等[32]发现改性橘果胶GCS-100 能诱导对地塞米松.美法仑或阿霉素有抗性的人类多发性骨髓瘤细胞系的凋亡,在化疗时使用改性果胶有助于在临床L减少有毒的化疗药物剂量,延缓肿瘤耐药性的发生。果胶的化疗增敏活性可能通过抑制 Gal-3 而逆转肿瘤耐药性[33]或者是与抑制Gal-3 对TRAIL 与 DR4/DR5 的相互作用有关[34],使肿瘤细胞对化疗药物由不敏感变为敏感。
2.3 改性果胶对转移的抑制
MPs 能通过抑制 Gal-3 而抑制肿瘤血管新生.失巢凋亡逃逸.血管内皮细胞黏附等转移过程[16,35-37]。血液循环中游离的Gal-3 而肿瘤转移有关,果胶进入血液后可能抑制游离的Gal-3 而抑制转移相关的过程[36]。此外,Gal-3 能下调G1-S 期㒚胞周期素水平(cyclin E 和 cyclin A),L调相关抑制蛋白(p21WAF1 和 p27KIP1)水平,使线粒体自稳[38-39]。此外,人参果胶具有抑制肿瘤细胞迁移的能力,使其有抗转移潜力[40]。
2.4 改性果胶对免疫细胞的作用
MPs能作为免疫调节剂(biological response modifiers, BRMs)激活免疫细胞[41]。MCP活化多种类型的Tc, B, NK 等免疫细胞或者刺激这些细胞释放 INF-γ等细胞因子[42-43]。游离Gal-3 能抑制Jurkat T细胞的生长,导致其发生凋亡[44-45]。此外,如果 MPs 能抑制Gal-3诱导的T细胞凋亡,߭有可能增强机体免疫监视作用。
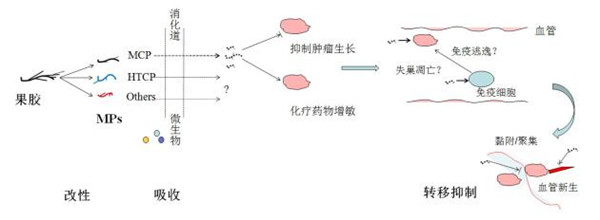
图 1 改性果胶作用机制示意图
Fig. 1 Schematic diagram of antitumor mechanisms for MPs.
3 MCP 活性的基础,可生物利用
以MCP 为代表的MPs 能在体内发挥抗肿瘤活性的前提是进入血液循环,即具有生物利用度[10,16]。为什么CP 没有抑制肿瘤转移的活性,而MCP具有这一活性?首先,水解使果胶分子的物理性质发生化,溶解度增加。碱使 CP 骨架 HG 通过β-消除作用而缩短,酯化度从大约 80%降低至10%以下, 溶解度增加。其次,分子的“药效基团”含量与分布状态在水解过程中发生改变。由于呋喃糖间的糖苷键比吡喃糖的糖苷键对酸更敏感,因而果胶的 RG-I 的木寡聚糖.阿拉伯寡聚糖等片段的酸解率大于半乳寡聚糖片段,酸使得果胶的骨架和毛发区链长缩短,部分阿拉伯半乳寡聚糖中的阿拉伯糖被水解,半乳寡聚糖被富集,从而增强了所谓“药效基团”末端β-半乳糖苷与其靶点 Gal-3 的糖识别结构域间的作用[46-47]。高酯果胶在水中呈疏水团聚物或凝胶状态,而 MCP 分子是可溶的,其末端β-半乳糖残基易于“呈现”给靶分子 Gal-3。另一个影响MCP 药代动力学性质的参数是分子量。MCP 分子量在3000~60 000 范围之间 [10,13,42]。分子大小可能从吸收和消除两方面决定着血药浓度。
MPs 生物利用度的高低与其理化性质和吸收机制有关。电荷可能是决定其生物吸收的重要因素。 采用Caco-2 双室细胞模型对 MCP 的跨膜吸收进行的研究,结果表明仅有果胶的中性寡糖片段穿越了膜,而富有半乳糖醛酸的果胶片段没有透过膜[48]。MPs或许可通过被动吸收或主动捕获(如通过小肠L皮细胞.肠相关淋巴组织.M细胞吸收等)两种方式而修饰.转运和释放[49-50]。
4 构效关系
SAR 研究尽管能指导分子结构优化以提高活性。然而,由于果胶结构非常复杂,MPs 虽然经过了初步纯化和分组,但是在微观上是不均一的。例如,酸性片段和中性片段具有不同的性质,而Gao 等[13]曾经采用DEAE 纤维素层析柱将MCP 的中性片段MCP-N 纯化出来。因此,多糖的SAR 称为“组效关系”或许更为确切。阐明MPs 的SAR 需要制备出结构更加一致的果胶片段。
MPs 存在于RG-I 的半乳糖末端含量及其结构是抗肿瘤活性的关键因素[13, 51]。荧光显微镜.流式细胞仪和原子力电镜技术均证实,果胶的半乳寡聚糖末端能够与Gal-3 相结合[51]。β-D-二聚半乳糖与Gal-3 间的解离常数为 0.33 s-1 [52]。黄秋葵果胶[53]和马铃薯果胶[54]具有较高比例的RG-I 片段,它们均
具有抗肿瘤活性。Gao 等[13]制备的MCP-N 属于果胶的AG-I 型片段。他们将MCP-N 用α-L-阿拉伯呋喃糖苷酶处理,得到中性果胶片段M-MCP。M-MCP 是一种分子量约为18 kDa 的具有β-1, 4 糖苷键的半乳寡聚糖片段。用酸降解M-MCP 得到的半乳寡聚糖比AG-I 类型的果胶片段具有更强的Gal-3 抑制活性。
HG 对抗肿瘤活性也存在贡献。首先,HG 可能与抑制细胞迁移活性有关。Fan 等[40]发现,人参果胶对L-929 细胞迁移的抑制与HG 相关,可能与RG-I 无关。其次,HG 可能与凋亡诱导活性有关。通过对CP 热处理获得HTCP,使HG 产生凋亡诱导活性,出现天然果胶中不存在的结构[4]。此外,MCP不具备诱导凋亡的活性。HG 经过β-消除改性会产生不饱和糖残基,这种糖残基或许与 MCP 诱导NK细胞的活性有关[42]。经过热处理,果胶会经β-消除产生带有还原性的不饱和糖残基.或发生重排或带有糖酸类结构特征的片段。MPs 或许可使肿瘤细胞产生失巢凋亡[55]。该活性与果胶的RG-I 还是HG相关,目前尚无定论[4,54],此外,HG 可能参与 Gal-3 的非特异性识别。尽管Gal-3 通过CRD K要与改性果胶的半乳寡聚糖发生专一的相互作用,但是,HG 骨架对抑制Gal-3 活性并非毫无贡献[56]。现有文献尚不足以支持仅仅RG-I 结构fl抑制肿瘤有关[6,54,57]。Gao 等[13]按照是否具有GalpA用色谱方法将MCP 分离为两组具有GalpA 的组称为 MCP-A,不含 GalpA 的组称为 MCP-N,前者对 Gal-3 的亲和力远远高于后者。果胶片段含有 GalpA 的骨架对于维持半乳寡聚糖末端片段的构象有贡献。分布于HG骨架L的多个半乳寡聚糖能够与Gal-3 发生协同相互作用[56]。糖配体与凝集素间如果发生多价效应(multivalent effect or glycocluster effect),其相互作用强度将增加。 改性果胶L HG 骨架,对于这些半乳寡聚糖配基而言,起到“桥”的作用。Gao 等[56]观察到了几乎不含半乳糖的果胶骨架与Gal-3间的相互作用,而这种相互作用不受乳糖的抑制。因此,改性果胶的骨架有可能与 CRD 之间发生非专一的相互作用。
MPs 上其它糖残基,例如阿拉伯糖会对其活性产生影响。Gao 等[56]观察到阿拉伯糖既可以增加也可以减少半乳寡聚糖片段与 Gal-3 间的相互作用。动物凝集素其配基的倒数第二个糖残基会影响其识别专一性[58]。由于体内有十几种半乳糖凝集素,因而,对配体末端糖残基结构的研究是必要的。研究改性果胶的抗肿瘤 SAR.代谢动力学等有助于推动筛选方案的建立,以获得性能更优的半乳糖凝集素凝集素抑制剂(galectin-3 inhibitor, Gal3I)。Gal-3 作为肿瘤靶点越来越引人关注,目前已经开发了许多Gal3I[59-60],Gal3I 在肿瘤检测和治疗方面有着巨大应用潜力。对于靶 Gal-3 而言,开发其抑制剂,并非只有以改性果胶为先导分子这一条路径,它受到其它方面的挑战。在研究化学合成的Gal3I 过程中,获得了许多 Gal-3 的 CRD fl配体间相互作用的规律。这些规律对于优化以改性果胶为先导分子的 Gal3I 的结构或许有帮助。由于化学合成的 Gal3I 尚无毒理学研究,因而,fl植物.尤其是食物资源中筛选Gal3I 的研究已经广泛开展[59, 61]。目前,尚缺少一套广泛认可的.高通量的 Gal-3I 筛选方法,能在改性果胶中及其它类型 Gal-3I 文库中筛选出活性更高.毒性更小的片段。
4 展望
由于MPs具有抑制肿瘤转移.改善化疗效果及增强免疫响应的活性,因而开发 MPs 为抗肿瘤功能食品潜力巨大。MPs 的活性可能与其RG-I 片段有关,同时其生物利用度也能影响活性。理解MPs的SAR,指导结构优化,有助于筛选出高活性组分。为了将 MPs 开发为功能食品,应重点深入研究果胶与靶点的药靶关系.获得更多的药效学.药代学以及临床研究数据。此外,一些与其作用机制和生物利用度有关的基础性问题也应阐明。例如,研究发现低分子量的果胶具有抗氧化能力[62],但果胶的抗氧化能力与抗肿瘤活性之间是否具有因果关系[6]?果胶能够与细胞因子发生相互作用,MPs是否与相关细胞因子发生作用,进而影响肿瘤的治疗[63]?由于低酯化度的果胶能够螯合一些金属离子,改性果胶在体内是否会对抗肿瘤类化疗药物产生影响?MPs 如何受到肠道菌群的影响?剂型和果胶的凝胶化如何影响其生物利用度?吸收促进剂能否增加 MPs 的生物利用度?阐明这些问题,将有助于改良 MPs 活性并促进其市场应用。
参考文献;
[1] WICKER L, KIM Y, KIM MJ, et al. Pectin as a bioactive polysaccharide – Extracting tailored function from less[J]. Food Hydrocolloids, 2014, 42(2): 251-259.
[2] ALMEIDA EA, FACCHI SP, MARTINS AF, et al. Synthesis and characterization of pectin derivative with antitumor property against Caco-2 colon cancer cells[J]. Carbohydrate Polymers, 2015, 115: 139-145.
[3] PLATT D, RAZ A. Modulation of the lung colonization of B16-F1 melanoma cells by citrus pectin[J]. Journal of the National Cancer Institute, 1992, 84(6): 438-442.
[4] JACKSON CL, DREADEN TM, THEOBALD LK, et al. Pectin induces apoptosis in human prostate cancer cells: Correlation of apoptotic function with pectin structure[J]. Glycobiology, 2007, 17(8): 805-819.
[5] HAO M, YUAN X, CHENG H, et al. Comparative studies on the anti-tumor activities of high temperature- and pH-modified citrus pectins[J]. Food & Function, 2013, 4(6): 960-971.
[6] KANG HJ, JO C, KWON JH, et al. Antioxidant and cancer cell proliferation inhibition effect of citrus pectin-oligosaccharide prepared by irradiation[J]. Journal of Medicinal Food, 2006, 9(3): 313-320.
[7] OLANO-MARTIN E, GIBSON GR, RASTELL RA. Comparison of the in vitro bifidogenic properties of pectins and pectic-oligosaccharides[J]. Journal of Applied Microbiology, 2002, 93: 505–511.
[8] CAFFALL KH, MOHNEN D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydrate Research, 344(14): 1879-1900.
[9] LECLERE L, CUTSEM PV, MICHIELS. Anti-cancer activities of pH- or heat-modified pectin[J].2013, 4, 128: 1-8. eCollection.
[10] 张文博, ߬长忠, 高林. 改性 橘果胶的制备, 表征及抗癌活性[J]. 高等学校化学学报, 2010, 31(5): 964-969.
[11] MOHNEN D. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277.
[12] YAPO BM, LEROUGE P, THIBAULT JF, et al.Pectins from citrus peel cell walls contain homogalacturonans homogenous with respect to molar mass, rhamnogalacturonan I and rhamnogalacturonan II[J]. Carbohydrate Polymers, 2007, 69(3): 426–435.
[13] GAO X, ZHI Y, ZHANG T, et al. Analysis of the neutral polysaccharide fraction of MCP and its inhibitory activity on galectin-3[J]. Glycoconjugate Journal, 2012, 29(4): 159-165.
[14] HINZ SW, VERHOEF R, SCHOLS HA, et al. Type I arabinogalactan contains β-D-Galp-(1-->3)-β-D-Galp structural elements[J]. Carbohydrate Research, 2005, 340(13): 2135-2143.
[15] LIU HY, HUANG ZL, YANG GH, et al. Inhibitory effect of modified citrus pectin on liver metastases in a mouse colon cancer
Progress in Anti-tumor Mechanisms of Modified Pectin
ZHANG Wen-bo1, LIU Zhen-hua1, YUAN Xue-yan2, GAO Qi-yu1,∗
(1. School of Life Sciences & Technology, Xinxiang Medical University;
2. School of Public Health, Xinxiang Medical University, Xinxiang Henan 453003, China)
Abstract: Pectin is a complex class of plant polysaccharides, composing galacturonan backbone and neutral sugar side chains. Antitumor modified pectin fragments (MPs) can be prepared by physical and/or chemical modification to decrease its molecular weight, reduce its degrees of esterification, modify its fine structure and improve its bioavailability. It was reported that MPs could inhibit tumor growth, induce apoptosis, sensitize tumor cell to chemotherapy drug, interfere angiogenesis, suppress metastasis and modulate immunological responses. In this review article, we will summarize the antitumor mechanisms, bio-absorption mechanism and structure-activity relationship of MPs. We also analyze the prospects for developing MPs into functional foods.
Key words: galectin-3 (Gal-3); modified pectin (MPs); modified citrus pectin (MCP); pectin; antitumorInitially, pectin can be modified into MPs using different methods, such as acid/base treatment and heat-treatment. Then, MPs, including MCP, HTCP and/or other modified pectin fragments can be absorbed partly by the gastrointestinal tract. Also, they may be degraded by the gut microbiota as dietary fiber and then absorbed by the body. Bioavailable MPs can probably inhibit tumor growth through modulating cell cycle or apoptosis pathway by binding Gal-3 in vivo. Additionally, MPs can facilitate chemo-therapy to some extent. It is speculated that MPs may be helpful for inducing cell death for those suffering from anoikis-resistance or immune escape. Last but not least, MPs can block tumor cell aggregation, inhibit angiogenesis and preclude tumor cell from lodging to the distant target organ, which is helpful for suppressing metastasis.
- 上一篇:果胶的抗肿瘤活性研究进展
下一篇:低分子柑橘果胶在肿瘤治疗中的研究进展 - 返回新闻列表

