- MCP、血管内皮抑素抑制结肠癌肝转移的作用研究
- 发布时间: 2019-02-22 点击次数:3660
MCP、血管内皮抑素抑制结肠癌肝转移的作用研究
刘海鹰, 黄志良, 杨国华
(广州医学院附属肿瘤医院腹部外科, 广东 广州 510095)
实用肿瘤杂志2008年 第23卷 第6期
摘要: 目的 修饰柑橘果胶(modified citrus pectin,MCP) 和血管内皮抑素(endo statin, ES) 已分别被证实能通过不同机制抑制肿瘤转移的形成。探讨不同浓度的M CP 及与ES 联用后对小鼠结肠癌肝转移的抑制作用。方法经小鼠脾脏下极包膜注入CT 226 结肠癌细胞建立结肠癌肝转移模型。135 只B albƒc 小鼠随机分为阴性对照组、阳性对照组、低剂量M CP 组、中剂量M CP 组、高剂量M CP 组、ES 组、低浓度M CP+ ES 组、中浓度M CP+ ES 组和高浓度M CP+ ES 组。M CP 加入饮用水中, 各组浓度分别为0、0、0101、01025、0105、0、0101、01025 及0105 gƒL , ES 剂量均为2 m gƒkg, 腹腔内给药, 隔天1 次。3 周后观察各组小鼠肝转移情况。制作肝转移瘤组织芯片, 用免疫组化方法检测肝转移瘤组织中galectin23、V EGF 的表达和肿瘤微血管密度(M VD ) , 采用酶联免疫吸附实验(EL ISA ) 方法检测小鼠血清galectin23 和V EGF 浓度。结果 (1) 除阴性对照组外, 各组肝转移率分别为100. 0%、8010%、7313%、6010%、8617%、7313%、7313% 和6010%。高浓度M CP 组、中浓度M CP+ ES 组、高浓度M CP+ ES 组与阳性对照组比较, 肝转移灶数目均明显减少(P < 0105); 高浓度M CP+ ES 组与ES 组比较, 肝转移灶数目明显减少(P < 0105)。
(2) 除阴性对照组外, 各组脾脏种植瘤体积中位数分别为 1151 cm 3、0193 cm 3、0177 cm 3、0170 cm 3、1125 cm 3、1115 cm 3、0175 cm 3 和0167 cm 3。中浓度M CP 组、高浓度M CP 组、中浓度M CP+ ES 组、高浓度M CP+ ES 组与阳性对照组比较, 脾脏种植瘤体积均明显缩小(P < 0105)。 (3) 各组肝转移瘤galectin23、V EGF 表达相互间比较无明显差异(P 值均> 0105)。 (4) 阳性对照组和各治疗组的血清galectin23、V EGF 浓度均明显高于阴性对照组(P 值< 0101);
阳性对照组与各治疗组相互间比较无明显差异(P 值均> 0105)。 (5) 各组肝转移瘤M VD 分别为 28147±3122、27147±3122、26192±1147 26191±2141、26143±1147、26150±3109、25145±1196 和24173±3109, 各浓度M CP+ES 组肝转移瘤M VD 计数与阳性对照组比较均有明显减少(P 值均< 0105)。
结论 单用M CP 或与ES 联用均能有效抑制结肠癌肝转移和微血管生成。
关键词: 结肠肿瘤; 肝肿瘤ƒ继发性; 肝肿瘤ƒ药物疗法; 果胶类; 内皮抑素类ƒ治疗应用; 基因疗法
据统计, 约50% 结直肠癌患者出现肝转移, 肝转移是影响结肠癌治疗效果和术后生存率的主要原因, 抑制肝转移有助显著提高结肠癌的疗效和生存率[ 1 ]。但目前通过针对肿瘤转移不同环节以抑制肝转移形成的研究不多。研究已证实M CP 的半乳糖成分能有效阻断galectin 23 的功能表达以抑制肿瘤转移形成, 血管内皮抑素(ES) 则能通过抑制新生血管形成限制肿瘤转移的形成。目前未有报道联合使用两者对肿瘤转移的影响。本研究主要利用结肠癌肝转移动物模型, 探讨M CP 联用ES 对结肠癌肝转移的抑制作用。
1 材料与方法
111 材料和仪器
11111 细胞株 小鼠结肠腺癌细胞株CT 226 由本院生物工程实验室传代保存。细胞使用R PM I21640细胞培养液(含 10% 新生小牛血清、青霉素 100 U ƒ m l、链霉素100 m gƒL ) , 37℃、5% CO 2 培养箱中进行传代培养。
11112 实验动物 6~ 8 周龄Balbƒc 雌性小鼠135只(由广东省医学动物实验中心提供, 动物合格证号: SCXK 粤2006A 019) , 体重20~ 25 g, 实验小鼠无特殊病原菌; 实验在中心SPF 级动物实验室进行。
11113 药物 M CP 由美国圣特莱公司提供。ES 由烟台麦得津生物公司提供。羊抗鼠ga lectin 23、V EGF和CD 34 免疫组化试剂盒均购自深圳晶美生物制品公司。
11114 主要仪器 美国Beecher 组织芯片仪, 多功能倒置相差显微摄影系统、上海科华ST 360 全自动多功能酶标仪。
112 方法
11211 结肠癌肝转移动物模型的建立 取处于指数生长期的CT 226 细胞加入适量生理盐水配成2× 106 ƒm l 细胞悬液。4% 水合氯醛腹腔注射麻醉小鼠 ( 011 m gƒ10 g) , 取左肋缘下平行肋缘切口, 打开腹腔, 在脾脏下极包膜注入CT 226 细胞悬液0105 m l, 1 号丝线间断缝合切口关腹。135 只小鼠随机分为 9组, 每组15 只: (1) 阴性对照组; (2) 阳性对照组; (3) 低浓度M CP 组(1% ) ; (4) 中浓度M CP 组(215% ) ; ( 5) 高浓度M CP 组( 5% ) ; ( 6) ES 组; ( 7) 低浓度M CP + ES 组; (8) 中浓度M CP+ ES 组; (9) 高浓度M CP+ ES 组。全部小鼠术后第2 天开始药物实验, M CP 加入饮用水中配成相应浓度, ES 隔天腹腔内注射 1 次, 对照组以同等量生理盐水代替饮用水和注射液。实验期间小鼠自由进食。
1. 2. 2 病理观察 实验3 周后摘眼球法采集小鼠
外周血提取血清, 引颈法处死小鼠。打开腹腔观察脾脏有无病灶, 记录肿瘤大小和数目。肿瘤体积V = ab2 ƒ2 (a: 肿瘤最大径; b: 肿瘤最小径) , 如有多个肿瘤则计算体积总和。仔细观察肝脏有无转移灶, 记录转移灶数目, 所有转移瘤均经病理切片H E 染色证实。根据周志伟等[ 2 ] 方法将肝转移灶数目分为四个等级进行统计: 0 级: 肝脏无转移病灶; I 级: 1~ 5 个转移病灶; " 级: 6~ 10 个转移病灶; ? 级: > 10 个转移病灶。
1. 2. 3 肝转移瘤组织芯片制作 复查H E 及免疫
组化染色切片, 选择典型癌灶(富有癌细胞且无坏死出血的区域)。用组织芯片仪在预先准备好的空白蜡块(25 mm ×25 mm ×20 mm ) 上按设计位置打孔, 孔径112 mm , 孔间距110 mm , 排成10 行×5 列共50 点微阵列。用112 mm 穿刺针将标记好的瘤体组织柱取出, 转移到空白蜡块的相应位置, 将 47 例组织芯安插于两个空白蜡块中, 其中每个组织芯蜡块含47 个组织芯(包括两个标记点)。将制成的组织芯蜡块面朝下置于铜板上55℃放置30 分钟, 轻压模块使组织柱在模块上排平, 冷却至室温, 蜡块在4℃×4 h 预冷后快速进行切片修整, 切片待用。
11214 免疫组化方法 对肝转移瘤组织芯片分别
进行galectin 23、V EGF 免疫组化染色, CD 34 免疫组化染色采用石蜡切片。所有操作严格按照免疫组化试剂盒说明进行(EnV isio n 法) , 结果判断由两名病理科医师双盲阅 片。 galectin 23 表达强度参考San juan 等[ 3 ] 的标准, V EGF 表达强度参考To i 等[ 4 ] 的标准, 均分为阴性(- )、弱阳性(+ )、阳性(+ + ) 和强阳性(+ + + )。M VD 计数参考W eidner 等[ 5 ] 的方法, 先在低倍镜下(×40) 确定肿瘤内新生血管最密集区作为“热点”进行血管计数, 然后在高倍镜下(×200) 计数5 个视野, 将5 个视野的血管平均数作为该切片的微血管密度值(M VD 值)。
11215 EL ISA 实验方法(双抗体夹心法) 小鼠外周血离心(3 000 rƒm in×5 m in) 提取血清, 严格按照 EL ISA 试剂盒说明书进行操作: 血清以1∶20 稀释后每孔加入100 Λl, 室温孵育2 小时, 洗板, 加入工作浓度辣根过氧化物酶标抗体 100 Λl, 室温孵育 2 小时, 洗板, 再加入100 Λl 底物四甲联苯胺, 室温避光孵育20 分钟, 加入50 Λl 终止液, 酶标仪450 nm 波长处读取吸光度(OD ) 数值。根据标准品OD 值拟合标准曲线回归方程和绘制标准曲线, 根据回归方程换算各样本galectin 23、V EGF 浓度。
113 统计学分析
所有数据采用SPSS 1010 软件进行统计学处理。 脾脏肿瘤体积、肝转移瘤数目、肝转移瘤组织galectin 23、V EGF 表达, 血清galectin 23、V EGF 浓度比较和M VD 计数比较均采用非参数检验方法。以P< 0105 具有统计学意义。
2 结 果
211 小鼠存活情况
实验3 周内无小鼠死亡。于第2 周后部分荷瘤小鼠外观可见腹部明显隆起肿块, 出现活动减少、反应迟缓、毛色暗淡、进食减少和精神萎靡等衰竭现象
(见图1)。
212 肝脏转移瘤数目
实验成功建立肝转移模型。除阴性对照组外, 各组 肝转移率分别为 100. 0%、8010%、7313%、6010%、8617%、7313%、7313% 和 6010%。中浓度
M CP 组、高浓度M CP 组、中浓度M CP+ ES 组、高浓度M CP + ES 组与阳性对照组比较, 肝转移灶数目均有明显减少(P < 0105)。
213 脾脏肿瘤体积
除阴性对照组外, 各组脾脏种植瘤体积中位数分别为 1151 cm 3、0193 cm 3、0177 cm 3、0170 cm 3、1125 cm 3、1115 cm 3、0175 cm 3 和 0167 cm 3。中浓度M CP 组、高浓度M CP 组、中浓度M CP+ ES 组、高浓度M CP + ES 组与阳性对照组比较, 脾脏种植瘤体积均有明显缩小(P < 0105)。各组脾脏肿瘤体积比较见表1
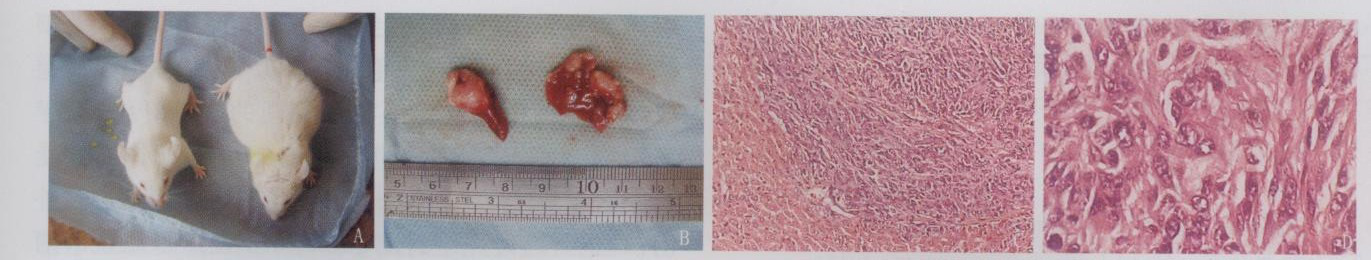
A : 荷瘤小鼠与正常小鼠 B: 脾脏原位肿瘤与肝转移瘤 C: 肝转移瘤病理图像(HE*200) D: 肝转移瘤病理图像(HE*400)
图1 小鼠结肠癌肝转移模型
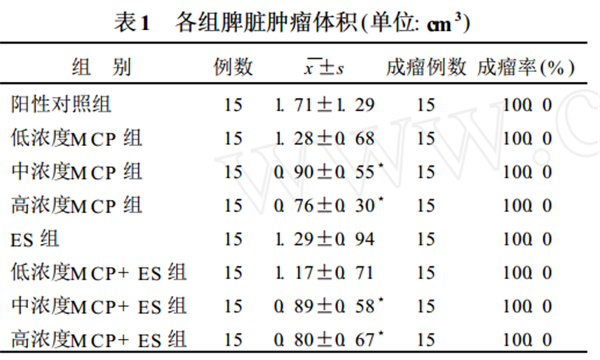
注 (1) 3 与阳性对照组比较, P < 0. 05; (2) 中浓度M CP 组与高浓度M CP 组比较、中浓度M CP+ ES 组与高浓度M CP+ ES 组比较、中浓度M CP 组与中浓度M CP+ ES 组比较、高浓度M CP 组与高浓度
M CP+ ES 组比较, 差异均无统计学意义(P > 0. 05)
214 肝转移瘤组织中 ga lectin-3 表达
显微镜下观察切片, 肿瘤细胞胞浆内染成棕黄
色颗粒认定为表达阳性细胞 (见图2)。经统计分析,
各组肝转移瘤组织 ga lect in23 表达无明显差异 (P > 0105)。 各组肝转移瘤 ga lect in23 表达比较见表 2。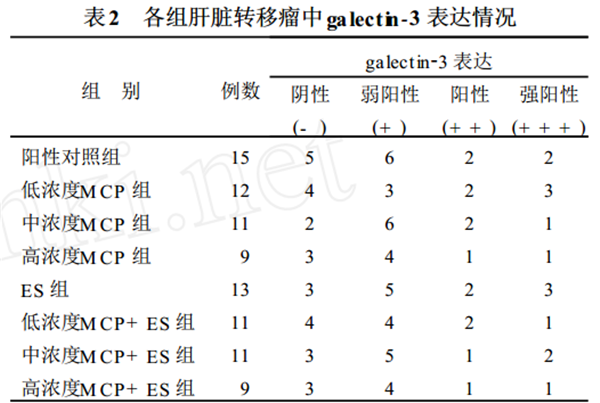
注 各组间比较, 结果差异均无统计学意义(P > 0. 05)
215 肝转移瘤组织中 VEGF 表达和M VD 计数
显微镜下观察切片, 肿瘤细胞胞浆内染成棕黄色颗粒认定为表达阳性细胞 (见图4)。经统计分析,
各组肝转移瘤组织 V EGF 表达无明显差异 (P >0105) , 见表3。在200 倍光镜视野下计数被CD 34 抗体 染成棕色的微血管数目 (见图3)。经分析, ES组、各浓度M CP + ES 组肝转移瘤M VD 计数与阳性对照组比较均有明显减少 (P < 0105)。但各M CP 治疗组与阳性对照组比较则无明显差异。 各治疗组相互间比较无明显差异见表4。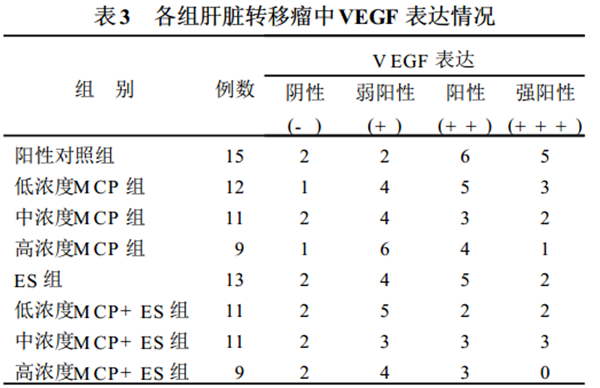

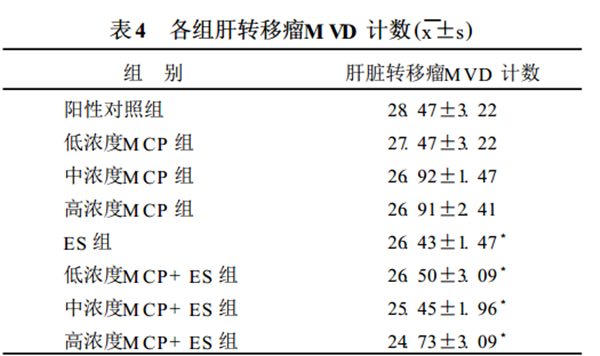
注 (1) 3 与阳性对照组比较, P < 0. 05; (2) 与阳性对照组比较,M CP 治疗组的M VD 计数差异无统计学意义 (P > 0. 05); (3) 与 ES组比较 各M CP 治疗组和M CP+ ES 治疗组的M VD 计数均无明显,
减少(P > 0. 05)
216 血清 ga lectin-3 浓度比较
根 据 标 准 曲 线 回 归 方 程 换 算 各 样 本 血 清ga lect in23 浓 度, 各 组 血 清 ga lect in23 浓 度 分 别 为( 14163 ± 10108 ) LgöL、( 91101 ± 22194 ) LgöL、( 82175 ± 20133 ) LgöL、( 79101 ± 17164 ) LgöL、
(85194±15152) LgöL、(88195±2176) LgöL、(86150± 19180) LgöL、(84170±15157) LgöL 和 (93198 ±
16191) LgöL。经检验, 阳性对照组和各M CP 治疗组血 清 ga lect in23 浓 度 明 显 高 于 阴 性 对 照 组 ( P < 0101) ; 阳 性 对 照 组 和 各 M CP 治 疗 组 之 间 血 清ga lect in23 浓度均无明显差异 (P > 0105)。
217 血清 VEGF 浓度比较
根据标准曲线回归方程换算各样本血清VEGF浓度, 各组血清V EGF 浓度分别为 (19150±4142)ngöL、( 411121 ±11198) ngöL、( 30172 ± 9175) ngöL、( 34180 ± 14189 ) ngöL、( 31193 ± 4176 ) ngöL、
(27197±6153) ngöL、(29157±6194) ngöL、(29177±7126) ngöL 和 (33117±10190) ngöL。 经检验, 阳性对照组和各M CP 治疗组血清V EGF 浓度明显高于阴性对照组 (P < 0101) ; 阳性对照组和各M CP 治疗 组 之 间 血 清 V EGF 浓 度 均 无 明 显 差 异 ( P >0105)。
3 讨 论
结肠癌肝转移形成是一个多步骤、多因素的过程。 游离肿瘤细胞的聚集和黏附是转移形成的关键环节, 其中黏附分子在肿瘤转移中起关键的作用[6];新生血管形成和营养供给是转移灶继发生长的重要原因, 也能为原位肿瘤细胞入血转移提供条件。目前发现在多种高转移 性肿瘤细胞 中 能 高 水 平 表 达ga lect in23[7], 肿瘤细胞表面的 ga lect in23 分子能直接介导肿瘤细胞间的识别聚集以及细胞与基底质的黏附锚定作用, 并有一定诱导新生血管形成、调节细胞生长的作用。修饰柑橘果胶M CP 是一种从柑橘类水果细胞壁中提取并经特定处理的多糖纤维, 其半乳糖成分能竞争性抑制体内 ga lect in23 配体与其受体结合, 从而封闭阻断 ga lect in23 的功能表达; 另外M CP 也可通过完全封闭 ga lect in23 位点以阻止肿瘤细胞从血管获取营养 对肿瘤生长有一定的抑制作,用[8, 9]。但目前尚未发现M CP 对肿瘤细胞有直接杀伤作用。 体外实验已证实,M CP 具有抑制肿瘤细胞同型聚集作用和抑制肿瘤细胞与内皮细胞、组织基质黏附的作用[10]; 动物实验也证明, 口服M CP 可抑制 鼠 前 列 腺 癌 和 人 乳 腺 癌、黑 色 素 瘤 的 自 发 转移[11~ 13]。 重组人血管内皮抑素是胶原— (co llagen— ) C 端 20kd 的连接蛋白, 能通过抑制血管内皮细胞的迁移和分裂以抑制新生血管形成 阻断肿瘤细胞营养供给, 从而达到抑制肿瘤增殖和转移的作用。体外细胞实验 ES 能抑制人微血管内皮细胞的迁移和微血管形成[14] 而对肿瘤细胞无直接杀伤作用。
动物实验和临床试验均证实 ES 对多种肿瘤的进展有明显抑制作用[14, 15]。 而目前尚未有关于M CP 与ES 联用对结肠癌肝转移影响的研究报道, 故本实验首次就M CP 与 ES 对结肠癌肝转移的影响作初步研究。
实验结果显示, 中、高浓度M CP 组, 中、高浓度M CP + ES 组的肝转移数明显少于阳性对照组, 表明单独使用一定浓度的M CP 或M CP 与 ES 联用能有效抑制结肠癌肝转移的形成, 从而也提示通过阻断肿瘤细胞的黏附聚集和新生血管的形成也可抑制肿瘤的转移。 而中、高浓度M CP 组和中、高浓度M CP + ES 组的脾脏肿瘤体积与阳性对照组比较有明显降低, 显示单独使用一定浓度的M CP 或M CP与ES 联用均可有效抑制肿瘤的生长。其机制可能是M CP 和 ES 能共同抑制肿瘤新生血管的形成 ,减少肿瘤的营养供给从而一定程度 抑 制 原 位 肿 瘤 的生长。免疫组化和 EL ISA 结果均显示 在有肿瘤生长和转移的情况下, 血清ga lect in23 和V EGF 的表达均较阴性对照组有明显升高。但M CP 并未降低各组肝转移瘤和血清ga lect in23 的表达, 只能明显抑制肝转移 的形成, 过去 P la t t 等[13] 通过动 物 实 验 也 证 实M CP 能有效抑制肿瘤的生长转移, 但通过W estern B lo t 检测发现M CP 对细胞 ga lect in23 的表达无影响。原因是M CP 只对肿瘤细胞表面的ga lect in23 有封闭阻断作用, 从而影响其生物学功能表达, 但不影响细胞表达和分泌ga lect in23。同样过去有研究也证实 ES 能 有 效 降 低 肿 瘤 组 织 M VD , 但 并 未 影 响V EGF 的表达[2]; 本实验结果也显示各组肝转移瘤 和血清V EGF 的表达也无明显差异 但M VD 却有下降趋势 表明通过使用ES 能有效抑制血管内皮细胞形成微血管的形成 并一定程度上抑制肿瘤的生长。但由于ES 的作用靶点是血管内皮细胞而非肿瘤细胞, 肿瘤细胞分泌表达V EGF 并不受影响, 这与传统抗癌药物通过直接杀伤肿瘤细胞减少V EGF 表达而引起M VD 降低的机制不同; 并且有观点认为这种抑制新生血管生长会加重瘤体内的相对缺氧, 反而会刺激肿瘤细胞分泌V EGF [15]。
实验中低浓度M CP 组、ES 组、低浓度M CP + ES 组的肿瘤生长和肝转移情况与阳性对照组比较未见明显差异 但随M CP 的浓度增加可见各指标均有下降趋势。而单用M CP 与M CP+ ES 治疗对脾脏种植瘤生长的影响并无显著差异, 均可能与本实验样本量较少、非参数检验方法敏感性较低有关, 需进一步增加样本量进行研究。
本研究结果表明, 单独使用一定浓度的M CP 或M CP 联合ES 能显著抑制结肠癌肝转移的形成和肿
瘤生长, 并能抑制转移瘤中M VD 数目, 提示通过同时阻断肿瘤细胞的聚集黏附和抑制新生血管形成能有效抑制结肠癌肝转移的形成, 这将为临床上防治结肠癌肝转移提供一个新的方向。M CP 作为一种来源于天然植物成分、高效低毒的药物, 可望为治疗结直肠癌肝转移和其它恶性肿瘤转移开辟新的方向,
并可根据肿瘤表达 ga lect in23 的情况为患者提供个性化的治疗策略。而ES 作为一种靶向药物其效果也日益受到重视。但由于M CP 和ES 对肿瘤细胞均无直接杀伤作用 两者如何联合化疗药物提高对结肠癌肝转移的疗效仍有待深入研究。
参考文献:
[ 1 ] 董锐增. 大肠癌肝转移的治疗进展 (综述) [J ]. 实用肿
瘤杂志, 2005, 20 (4) : 363- 366.
[ 2 ] 周志伟, 万德森, 王国强, 等. 血管生成抑制剂YH 216 抑
制 结肠癌肝转移的研究[J ]. 癌症, 2006, 25 (7) : 818- 822.
[ 3 ] Sanjuan X, Fernandez PL , Castells A , et al.
D ifferential exp ression of galectin23 and galectin21 in co lo rectal cancer p rogression [J ]. Gastroentero logy, 1997, 113 (6) : 1906- 1915.
[ 4 ] To i M , Ho sh ina S, T akayanagi T , et al. A ssociation of
vascular endo thelial grow th facto r exp ression w ith tum o r angiogenesis and w ith early relap se in p rim ary breast cancer [J ]. Jpn J Cancer R es, 1994, 85 ( 10) :1045- 1049.
[ 5 ] W eidner N. Intratum o r m icrovessel density as a
p rogno stic facto r in cancer [J ]. Am J Patho l, 1995, 147 (1) : 9- 19. R eview.
[ 6 ] 季加孚. 结直肠癌肝转移的分子生物学基础[J ]. 实用
肿瘤杂志, 2003, 18 (2) : 84- 87.
[ 7 ] N akam ura M , Inufusa H ,A dach i T , et al. Invo lvem ent
of galectin23 exp ression in co lo rectal cancer p rogression and m etastasis [J ]. Int J O nco l, 1999, 15
(1) : 143- 148.
[ 8 ] H ughes RC. Galectins as m odulato rs of cell adhesion
[J ]. B ioch im ie, 2001, 83 (7) : 667- 676.
[ 9 ] Zou J , Glinsky VV , L andon LA , et al. Pep tides
specific to the galectin23 carbohydrate recognition
dom ain inh ibit m etastasis2associated cancer cell adhesion [J ]. Carcinogenesis, 2005, 26 (2) : 309.
[ 10 ] Inohara H , R az A. Effects of natural com p lex
carbohydrate (citrus pectin) on m urine m elanom a cell
p roperties related to galectin23 functions [ J ]. Glycoconj J , 1994, 11 (6) : 527- 532.
[ 11 ] N angia2M akker P, Hogan V , Honjo Y, et al.
Inh ibition of hum an cancer cell grow th and m etastasis in nude m ice by o ral intake of m odified citrus pectin [J ]. J N atl Cancer Inst, 2002, 94 (24) : 1854- 1862.
[ 12 ] P ient KJ , N aik H , A kh tar A , et al. Inh ibition of
spontaneous m etastasis in a rat p ro state cancer m odel by o ral adm inistration of m odified citrus pectin [J ]. J N atl Cancer Inst, 1995, 87 (5) : 331- 332.
[ 13 ] P latt D , R az A. M odulation of the lung co lonization
of B 162F1 m elanom a cells by citrus pectin [ J ]. J N atl Cancer Inst, 1992, 84 (6) : 438- 442.
[ 14 ] te V elde EA , R eijerkerk A , B randsm a D. Early
endo statin treatm ent inh ibits m etastatic seeding of m urine co lo rectal cancer cells in the liver and their adhesion to endo thelial cells [J ]. B r J Cancer, 2005, 92 (4) : 729- 735.
[ 15 ] te V elde EA , V ogten JM , Gebbink M F. Enhanced
antitum our efficacy by com bining conventional chem o therapy w ith angio statin o r endo statin in a liver m etastasis m odel [J ]. B r J Surg, 2002, 89 (10) :1302- 1309.·514· Journal of Practical Oncology Vol. 23 No. 6 2008
Inh ibitory effect of modif ied citrus pectin and endosta tin on l iver m eta sta s is from colon cancer
L IU Haiying, HUANG Zh iliang, YANG Guohua
(Departm ent of A bdom inal Surgery, T he A ffiliated Cancer Hosp ital of
Guangzhou M edical Co llege, Guangzhou, 510095, Ch ina)
Abstract: Objective To investigate the inh ibito ry effect of m odified citrus pectin (M CP ) com bined w ith endo statin
(ES) on liver m etastasis from co lon cancer in m ouse. M ethods CT 226 co lon cancer cells w ere injected into the subcap sule of
sp leen in Balböc m ouse to establish a co lon cancer liver m etastasis m odel. O ne hundred and th irty2five m ouse w ere divided into 9 group s random ly: negative contro l group , po sitive contro l group , low M CP group , m edium M CP group and h igh M CP
group , ES group , low M CP + ES group , m edium M CP + ES group and h igh M CP + ES group. T he concentrations of M CP in w ater w ere 0. 0, 0. 0, 0. 01, 0. 025, 0. 05, 0. 0, 0. 01, 0. 025, 0. 05 göL , respectively. T he concentration of ES w as 2 m gökg,
injected into the abdom inal cavity once every 2 days. T he liver m etastasis w as observed after 3 w eek s. T he exp ressions of galectin23, vascular endo thelial grow th facto r (V EGF ) and tum o r m icrovessel density (M VD ) in liver m etastasis w ere
exam ined w ith tissue m icroarray technique and imm unoh istochem istry. T he concentrations of galectin23 and V EGF in serumw ere detected by enzym e linked imm uno so rbent assay (EL ISA ). Results T he percentage of liver m etastasis in each groupw as 100. 0% , 80. 0% , 73. 3% , 60. 0% , 86. 7% , 73. 3% , 73. 3% , 60. 0%. T he num ber of liver m etastases in h igh M CP group ,m edium M CP + ES group and h igh M CP + ES group w as significantly few er than that in po sitive contro l group (P < 0. 05). T he num ber of liver m etastases in h igh M CP + ES group w as significantly few er than that in h igh M CP group (P < 0. 05).
T he m edian vo lum e of sp leen im p lanted tum o r in each group w as 1. 51 cm , 0. 93 cm , 0. 77 cm , 0. 70 cm , 1. 25 cm , 1. 15 cm ,
0. 75 cm and 0. 67 cm . T he size of sp leen im p lanted tum o r in m edium M CP group , h igh M CP group , m edium M CP+ ES group and h igh M CP + ES group w as sm aller com pared w ith po sitive contro l group (P < 0. 05). T he exp ression of galectin23 and
V EGF in liver m etastasis in each group w as no t significantly different (all P > 0. 05). T he concentration of galectin23 and V EGF in serum in po sitive contro l group and all treatm ent group s w as significantly h igher than that of negative group (P <
0101 ). T here w as no significant difference betw een the po sitive contro l group and treatm ent group s (all P > 0. 05). T he M VD counts in liver m etastases w ere 28 47±3 22 27 47±3 22 26 92±1 47 26 91±2 41 26 43±1 47 26 50±3 09
. . , . . , . . , . . , . . , . . , 25145±1. 96 and 24. 73±3. 09, respectively. Com pared w ith po sitive contro l group , the M VD of liver m etastasis focus in ES group , low M CP + ES group , m edium M CP + ES group and h igh M CP + ES group w as significantly low er (P < 0. 05).
Conclusion M CP alone o r com bine w ith ES can inh ibit liver m etastasis from co lon cancer and angiogenesis effectively in m ouse.
Key words: co lonic neop lasm s; liver neop lasm sösecondary; liver neop lasm södrug therapy; pectins; endo statinsö
therapeutic use; gene therapy- 上一篇:改性柑橘果胶MCP激活T辅助/诱导细胞,毒性T-细胞,B细胞
下一篇:口服改性柑橘果胶抑制大鼠前列腺癌模型中的自发转移 - 返回新闻列表

