- 小鼠结肠肿瘤模型中改性柑橘果胶对肝脏转移的抑制作用
- 发布时间: 2018-12-26 点击次数:3880
小鼠结肠肿瘤模型中改性柑橘果胶对肝脏转移的抑制作用
《世界胃肠病学杂志》2008年12月28日,14卷48号
翻译:Tiffany Yang
摘要
目的:探讨小鼠体内结肠癌中半乳糖凝集素-3在肝转移中的表达,并通过改性柑橘果胶(MCP)抑制。
方法:七十五个BALB/ c小鼠随机分为阴性对照组(N= 15),阳性对照组(N= 15),低MCP浓度组(N= 15),中间MCP浓度组(N= 15)和高MCP浓度组(N= 15)。除阴性对照组外,在阳性对照组,低,中,高MCP浓度组中,将CT26型结肠癌细胞注入小鼠脾包膜下,以建立一个结肠癌肝转移模型。饮用水MCP浓度分别是0.0%,0.0%,1.0%,2.5%和5.0%(重量/体积)。3周后观察结肠癌肝转移。酶联免疫吸附试验(ELISA)用于检测血清中半乳糖凝集素-3的浓度。肝转移中半乳糖凝集素-3的表达用免疫组化检测。
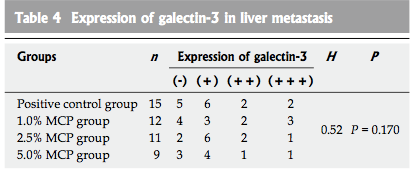
结果: 除阴性对照组外,其他4组肝转移率分别为100%,80%,73.3%和60%。高MCP浓度组肝转移的数量明显比阳性对照组(P = 0.008)少。除阴性对照组外,其他4组植入脾脏肿瘤体积中位数分别为1.51立方厘米,0.93立方厘米,0.77 cm3和0.70立方厘米。中、高MCP浓度组植入肿瘤的体积明显比阳性对照组(p =0.019,P= 0.003)更小。阳性对照组和MCP治疗组血清半乳糖凝集素-3的浓度显著高于阴性对照组。然而,它们之间没有显著差异。除阴性对照组外,其他4组肝转移半乳糖凝集素-3的表达没有表现出显著差异。
结论:结肠癌肝转移中半乳糖凝集素-3表达的显著增加可被MCP有效的抑制。
关键词:果胶;结肠肿瘤;转移;肝;小鼠
引言
肝转移是影响大肠癌治疗效果和术后预测的主要原因。抑制肝转移对大肠癌治疗效果和术后预测是有益的。 半乳糖凝集素-3,一种肿瘤细胞表面的碳水化合物结合蛋白,与细胞间粘附、体外癌细胞聚集、体内肿瘤生长和转移密切相关。 半乳糖凝集素-3在多种转移性肿瘤细胞中出现[4]。半乳糖,改良柑橘果胶(MCP)的主要成分,可以专门抑制体内肿瘤的生长和转移及体外半乳糖凝集素-3的介导功能[5]。关于MCP对肿瘤转移抑制作用的研究非常的少。本研究的目的是讨论结肠癌模型中MCP对大鼠肝转移的抑制作用。
材料和方法
细胞株
在我们的生物技术实验室保存和传代培养的小鼠结肠腺癌细胞株(CT-26),培养在37℃含有10%新出生小牛血清,青霉素G和链霉素的RPMI-1640培养基中,置于含有50 mL / L二氧化碳的5%的CO2培养箱中。
动物
这项研究中使用由广东省医学实验动物中心(认证号:2006A019)提供的七十五个6-8周龄体重20-25克的BALB/ c雌性小鼠。小鼠无特定病原体。实验在SPF动物实验室进行。
药品和试剂
MCP是由Centraxinc国际股份有限公司提供(旧金山,美国)。小鼠半乳糖凝集素-3的检测试剂盒由R&D公司(明尼阿波利斯,美国)提供。小鼠半乳糖凝集素-3的亲和纯化聚合酶购自精美生物科技有限公司(中国上海)。
主要设备
美国比彻组织芯片仪,ST360自动酶标仪购自科华(中国上海)。
小鼠结肠癌肝转移模型的建立
七十五个BALB/ c小鼠随机分为阴性对照组,阳性对照组,低MCP浓度组,中间MCP浓度组和高MCP浓度组。饮用水中的MCP浓度分别是0.0%,0.0%,1.0%,2.5%和5.0%(重量/体积)。呈指数增长有足够NS的CT26细胞用来混合成悬浮液(1×106/mL)。小鼠腹腔注入4%水合氯醛(10毫升/公斤)麻醉,之后于平行左侧肋下缘腹壁处进行切口。随后进行了手术,将CT-26和0.05毫升悬浮液注入脾。将相同体积的生理盐水注射到阴性对照组小鼠腹腔中。切口用#1缝合。手术后第2天开始到第21天剖检日所有的老鼠持续接受溶解MCP的饮用水。给予阴性对照组相同体积的蒸馏水。实验全程所有的老鼠自由接触食品和水。
观察
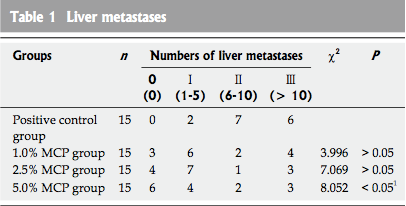
经过3周的观察,小鼠的眼球被移除以收集外周血0.5-1.0毫升。所有的老鼠断头处死。腹腔被打开以观察脾脏原发性肿瘤并记录肿瘤的体积和数量(体积= AB2/ 2,a=最大直径,b =最小直径)。 如果有超过2个肿瘤则记录总体积。肝转移数量计数。所有肿瘤HE染色鉴定。肝转移如前所述被分为4个等级:0级:无肝转移;Ⅰ级:1-5例肝转移;Ⅱ级:6-10例肝转移;Ⅲ级:超过10例肝转移。
半乳糖凝集素-3的ELISA分析
血液样本以3000转/分离心5分钟以分离血清。分离血清存放在≤-20℃的环境下。血清样品以稀释剂1:20稀释。总之,100μL稀释液加入到培养皿的每个反应孔中,并在室温下培养2小时,培养皿用洗涤液清洗。一百微升检测抗体被添加到培养皿的每个反应孔中,置于室温下培养2小时,培养皿用洗涤液清洗。一百微升的工作稀释剂链霉HRP加入到培养皿的每个反应孔中,培养在黑暗室温环境20分钟,之后清洗培养皿。最后,100μL基质溶液添加到培养皿的每个反应孔中培养在黑暗室温环境20分钟,随后50μL的停止液被添加到培养皿的每个反应孔中。微孔板读取器用于读取在450 nm处的吸光度,然后绘制标准曲线和公式,用于符合标准样品的OD值。
肝转移组织芯片
肝组织切片用HE染色以选择典型的观察处,如一个肿瘤丰富的区域,但要没有坏死区和出血。用组织芯片仪来将石蜡块穿孔(25毫米×25毫米×20毫米)。每个洞的直径为1.2毫米,两洞之间的距离为1.0毫米。五十个孔被排成10排和5列。用长1.2毫米的穿刺针绘制出显着典型的组织核心,并把它转移到石蜡块的某个位置。 47个转移样本被安排到2个蜡块中。每个样品包括2个显着的核心。组织阵列石蜡切片保存在55℃铜板3 0分钟。轻轻按下石蜡块来阵列组织内核,冷却于室温。阵列进行切片后迅速预冷在4℃4小时。
免疫组织化学分析
组织样本切片用半乳糖凝集素-3免疫组化按照半乳糖凝集素-3亲和纯化多克隆抗体说明染色。部分石蜡切片和水合。用PBS洗涤后,切片以3%过氧化氢在室温下培养10分钟,与抗体在室温下培养10分钟,与EnVision在室温下培养30分钟,最后用DAB染色。结果由2名病理学家进行双盲判断。 半乳糖凝集素-3的表达水平如前所述分为阴性( - ),弱阳性(+),阳性(++)和强阳性(+++)。
统计分析
所有数据都是用SPSS10.0软件进行分析的。肿瘤体积,肝转移数量,血清和组织中半乳糖凝集素-3浓度都进行了非参数分析测试。
结果
小鼠的生活状态
没有小鼠在3周实验期间死亡。一些老鼠被发现有肿块,鼓鼓的在腹壁。一些癌症携带小鼠出现精神抑郁的迹象,如减少活动,响应速度慢,毛发颜色暗淡,食欲不振(图1)。
图一:结肠癌肝转移小鼠模型
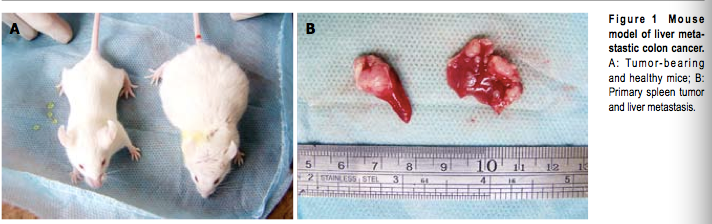
*A.带有肿瘤的健康小鼠;B. 原发脾脏肿瘤和肝转移。
转移性肝癌
除阴性对照组,用高,中,低MCP浓度治疗的其他4组肝转移率分别为100%,80%,73.3%和60%。高MCP浓度组的肝转移数量显著低于中、低MCP浓度组(P <0.05)(见表1)。
表一 肝转移
脾脏原发性肿瘤体积
高,中,低MCP浓度组植入脾脏肿瘤体积中位数分别是1.51立方厘米,0.93立方厘米,0.77立方厘米和0.70立方厘米。阴性对照组中未发现肿瘤。 高MCP浓度组的肿瘤体积明显低于中、低MCP浓度组(P <0.05)(表2,图2)。
图二
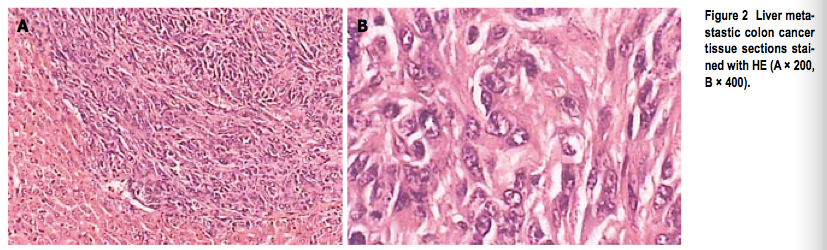
* 肝转移结肠癌组织切片HE染色(A*200, B*400)
表二:原发脾脏肿瘤量

血清中半乳糖凝集素-3的浓度
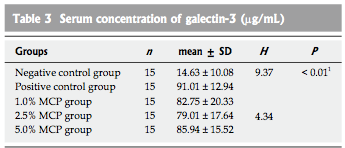
根据标准回归公式计算血清样品中半乳糖凝集素-3的浓度,阴性对照组为(14.63±10.08)纳克/毫升,阳性对照组为(91.01±22.94)纳克/毫升,低MCP浓度组为(82.75±20.33)纳克/毫升,中间MCP浓度组为(79.01±17.64)纳克/毫升,高MCP浓度组为(85.94±15.52)纳克/毫升。结果表明,阳性对照组和MCP处理组血清中半乳糖凝集素-3浓度显着高于阴性对照组(P <0.01,表3)。
表三:半乳糖凝集素-3血清浓度(微克/毫升)
半乳糖凝集素-3在肝转移的表达
显微镜下细胞液中棕色细胞被认为是阳性细胞。转移性肝癌组织中阳性细胞百分率显示半乳糖凝集素-3在肝脏转移阳性对照组和MCP治疗组没有显著的差异(图3,表4)。
图三
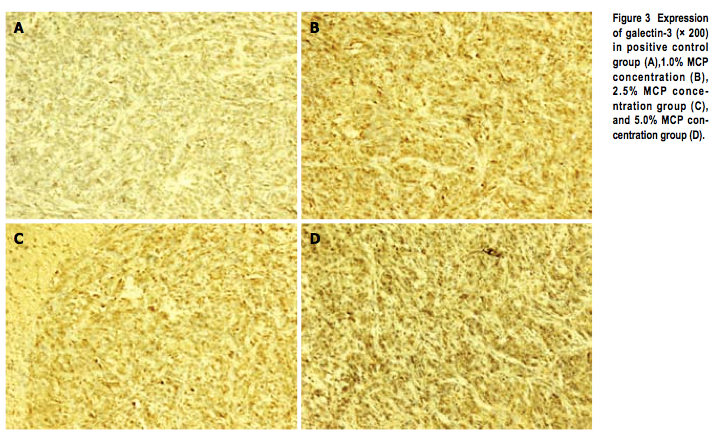
* 阳性对照组中半乳糖凝集素-3(*200)的表现(A), 1.0% 浓度MCP(B), 2.5%浓度MCP组(C), 5%浓度MCP组(D)。
表四:肝转移中半乳糖凝集素-3的表达
讨论
结肠癌肝转移包括肿瘤细胞渗透,剥离,粘附,聚集和入侵,其中涉及碳水化合物介导的识别蛋白,例如半乳糖凝集素。肿瘤细胞粘附癌栓和肿瘤细胞碇泊处粘附血管内皮或基底膜是结肠癌肝转移的两个关键步骤。表现在不同阶段的半乳糖凝集素在肿瘤进程中可能起到至关重要的作用。 半乳糖凝集素-3是凝集素家族的成员,是一个多功能的致癌蛋白,调节细胞的生长,粘附,增殖和凋亡,以及细胞间的相互作用和血管生成。大量的证据已经证实癌细胞转移显著表达半乳糖凝集素-3,半乳糖凝集素-3的高表达性可在原发性和转移性病变检测到,甚至实在血液中,使得与肿瘤生长和转移呈现出强劲的关系。此外,半乳糖凝集素-3的表达可以用来作为大肠癌的诊断和预后指标。因此,如果半乳糖凝集素-3的功能受阻,粘附和聚集的进展可以被打断,这可能促进治疗大肠癌和其他癌症的新药的开发。
MCP是一种从柑橘类水果派生的不易消化的水溶性多糖纤维,同时也是一个复杂的富含多糖的半乳糖残基。 MCP可以特定的抑制碳水化合物结合蛋白亲和配体。当MCP的浓度达到适当的水平,癌细胞表面的半乳糖凝集素-3蛋白将几乎被MCP分子完全阻断。因此,肿瘤细胞之间的粘附和聚集将被阻断。此外,MCP可以通过阻断半乳糖凝集素-3抑制内皮细胞形态和血管生成,从而拦截癌细胞从容器和癌症进程吸收营养。然而,没有证据说明MCP直接或间接攻击癌细胞及有无毒性和副作用。体外实验表明,MCP能够抑制癌细胞粘附层粘连蛋白和同型聚集。动物实验也表明,口服MCP可以抑制大鼠前列腺癌细胞、人乳腺癌细胞和黑色素瘤细胞的生长和转移。
我们的研究结果显示,MCP可以有效抑制小鼠脾脏植入结肠癌的生长和转移。高MCP浓度组的肝转移和肿瘤体积明显比对照组少,
表明MCP可以在一定剂量抑制结肠癌生长和转移,这与报告的数据是一致的。相比之下,低MCP浓度组结肠癌生长和肝转移无显著差异,这可能是由于缺乏样本和低非参数统计的灵敏度。仍然需要进一步的研究来澄清MCP浓度在这方面的作用。
ELISA和免疫组化分析表明,MCP不影响肝转移肿瘤细胞中半乳糖凝集素-3的浓度和表达,但可以抑制体外的肝转移。其机制可能是MCP只是阻隔癌细胞表面的半乳糖凝集素-3分子,但不会拦截表达或肿瘤细胞的分泌。据最近报道,半乳糖凝集素-3的可作为诊断大肠癌的一个可靠标志物,也是癌症治疗中的目标蛋白之一。
总之,MCP能通过阻碍肿瘤细胞的粘附和聚集有效地抑制结肠癌和肝转移增长。 MCP作为从水果提取的的一种天然多糖和无毒
药物,可为控制结肠癌和其他癌症的生长和转移铺平了一条新的途径。MCP和化疗药物联合使用以控制和治疗结肠癌肝脏转移的作用仍需要进一步研究。
Inhibitory effect of modified citrus pectin on live metastases
Abstract
Splanchnic or gastrointestinal ischemia is rare and randomized studies are absent. This review focuses on new developments in clinical presentation, diagnostic approaches, and treatments. Splanchnic ischemia can be caused by occlusions of arteries or veins and by
physiological vasoconstriction during low-flow states.The prevalence of signifcant splanchnic arterial stenoses is high, but it remains mostly asymptomatic due to abundant collateral circulation. This is known as chronic splanchnic disease (CSD). Chronic splanchnic syndrome(CSS) occurs when ischemic symptoms develop. Ischemic symptoms are characterized by postprandial pain, fear of eating and weight loss. CSS is diagnosed by a test for actual ischemia. Recently, gastro-intestinal tonometry has been validated as a diagnostic test to detect splanchnic ischemia and to guide treatment. In singlevessel CSD, the complication rate is very low, but some patients have ischemic complaints, and can be treated successfully. In multi-vessel stenoses, the complication rate is considerable, while most have CSS and treatment should be strongly considered. CT and MR-based angiographic reconstruction techniques have emerged as alternatives for digital subtraction angiography for imaging of splanchnic vessels. Duplex ultrasound is still the first choice for screening purposes. The strengths and weaknesses of each modality will be discussed.CSS may be treated by minimally invasive endoscopic treatment of the celiac axis compression syndrome,
endovascular antegrade stenting, or laparotomy-assisted retrograde endovascular recanalization and stenting.- 上一篇:改良柑橘果胶(MCP)增加男性前列腺癌患者前列腺特异性抗原倍
下一篇:利用改性柑橘果胶抑制肿瘤转移和缓解重金属毒性 - 返回新闻列表

